体外诊断试剂质量管理体系核查要点解析---厂房与设施
Ø 厂房设计要求
• 厂房设施应当符合产品生产要求:
诊断试剂产品按风险程度的分类
• 第一类产品:
1.微生物培养基(不用于微生物鉴别和药敏试验);
2.样本处理用产品,如溶血剂、稀释液、染色液等。
1.微生物培养基(不用于微生物鉴别和药敏试验);
2.样本处理用产品,如溶血剂、稀释液、染色液等。
• 第二类产品:
1.用于蛋白质检测的试剂;
2.用于糖类检测的试剂;
3.用于激素检测的试剂;
4.用于酶类检测的试剂;
5.用于酯类检测的试剂;
6.用于维生素检测的试剂;
7.用于无机离子检测的试剂;
8.用于药物及药物代谢物检测的试剂;
9.用于自身抗体检测的试剂;
10.用于微生物鉴别或者药敏试验的试剂;
11.用于其他生理、生化或者免疫功能指标检测的试剂。
1.用于蛋白质检测的试剂;
2.用于糖类检测的试剂;
3.用于激素检测的试剂;
4.用于酶类检测的试剂;
5.用于酯类检测的试剂;
6.用于维生素检测的试剂;
7.用于无机离子检测的试剂;
8.用于药物及药物代谢物检测的试剂;
9.用于自身抗体检测的试剂;
10.用于微生物鉴别或者药敏试验的试剂;
11.用于其他生理、生化或者免疫功能指标检测的试剂。
第三类产品
1.与致病性病原体抗原、抗体以及核酸等检测相关的试剂;
2.与血型、组织配型相关的试剂;
3.与人类基因检测相关的试剂;
4.与遗传性疾病相关的试剂;
5.与麻醉药品、精神药品、医疗用毒性药品检测相关的试剂;
6.与治疗药物作用靶点检测相关的试剂;
7.与肿瘤标志物检测相关的试剂;
8.与变态反应(过敏原)相关的试剂。
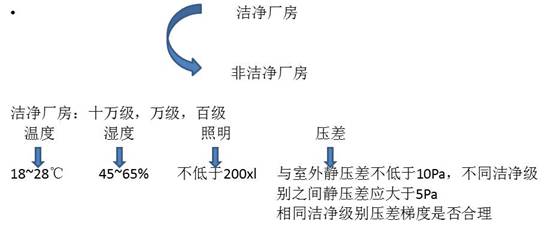
• 厂房硬件条件需求
非洁净厂房:一般清洁环境 (不含生物活性材料产品如无机离子类试剂)
• 洁净区内表面(墙面,地面,天棚、操作台)应当平整光滑,无裂缝、接口严密,无颗粒物脱落,避免积尘,并便于清洁处理和消毒。
• 墙面:岩棉板或泡沫板 地面:环氧树脂自流平、PVC卷材、聚氨酯地面
• 厂房设施应当符合要求:
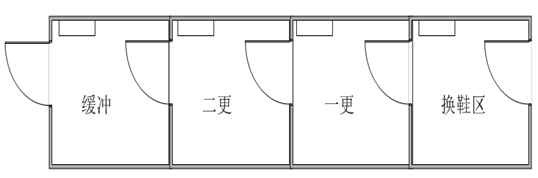
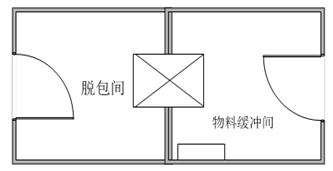
• 洁净区和非洁净区之间应有缓冲设施
注意:人流入口(图1)和物流入口(图2)
图一
图2
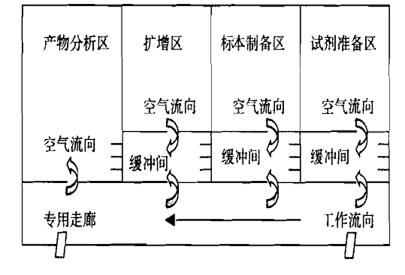
Ø 关于生产聚合酶链式反应(PCR)试剂的检验和生产应当在独立的建筑物或空间内,保证空气不直接联通,防止扩增时形成的气溶胶造成交叉污染。
Ø PCR检验室有独立的设计要求
缓冲间为负压的理想PCR实验室设置模式
缓冲间为正压的理想PCR实验室设置模式
• 阴性或阳性血清、质粒或血液制品的处理操作,生产区域应不低于万级,并应当与相邻区域保持相对负压。
• 无菌物料的分装处理操作区域应当符合局部百级洁净度级别
• 生产激素,操作有致病性病原体或芽孢菌制品应当使用单独的空调净化系统,与相邻的区域保持负压,排出的空气不能循环使用。
Ø 明确要求人流,物流包装线与其他一般品种生产线不能共用。
• 现场体系考核,生产,质检,研发场地往往都是首先被检查,检查过程一定要注意细节,在日常工作中建立良好的规范操作。
体外诊断试剂质量管理体系核查要点解析---设备
Ø 空气净化系统:
Ø 风冷机和水冷机两种---保证三级过滤系统
• 空气净化系统能否达到相应的洁净级别
• 空气净化系统验证,尤其是系统不连续使用情况下,要明确洁净室重新开启后能够使用的要求---如自净30min、温度、湿度等要求
• 未进行验证,停机后应对环境参数进行检测!
• 空调验证环境监测参照-----YY0033-2000 无菌医疗器具生产管理规范
ü 生产,质检,十万级,万级空调系统的对立性!